FDA odobrila prvi lijek za liječenje karcinoma Merkelovih stanica
Američka Agencija za hranu i lijekove (FDA), prošli je tjedan odobrila primjenu imunoterapeutika avelumaba za liječenje karcinoma Merkelovih stanica. Avelumab je prvi lijek kojeg je FDA odobrila za liječenje ovog rijetkog i agresivnog karcinoma kože.
Inače, karcinom Merkelovih stanica se svake godine u SAD-u dijagnosticira u oko 1.600 ljudi. Iako se u većine pacijenata spomenuti karcinom dijagnosticira dok je još lokalizirani tumor, te se može liječiti kirurškim zahvatom, valja istaknuti da u oko polovice pacijenata dolazi do recidiva bolesti, a više od 30 posto njih će imati metastatsku bolest.
Karcinom Merkelovih stanica nastaje iz neuroendokrinih stanica i ima nepredvidivo kliničko ponašanje te loš klinički ishod. Brzo raste i javlja se većinom u osoba starijih od 50 godina. Smrtonosniji je od melanoma, a u posljednjih nekoliko desetljeća, njegova se učestalost učetverostručila zbog sve većeg prekomjernog izlaganja UV zrakama i imunosupresije. Karcinom Merkelovih stanica je 10-30 puta češći u imunosuprimiranih pacijenata. U oko 80 posto oboljelih prisutan je poliomavirus Merkelovih stanica.
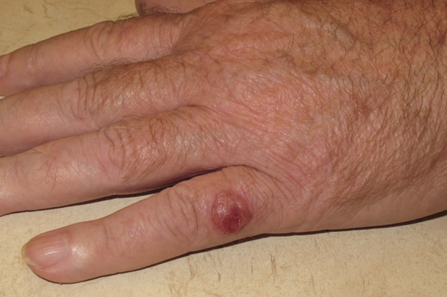
Karcinom Merkelovih stanica se obično pojavljuje u obliku sjajnih kvržica koje rastu iz folikula sa bojom koja se proteže od ružičaste do crvene ili plave na mjestima izloženim suncu.
U pacijenata koji su liječeni avelumabom u 33 posto slučajeva uočeno je potpuno ili djelomično smanjenje tumora. Odgovor na imunoterapiju je trajao više od 6 mjeseci u 86 posto pacijenata koji su reagirali na terapiju, a dulje od 12 mjeseci u 45 posto pacijenata.
Nuspojave koje su uočene nakon primjene avelumaba uključuju umor, mišićno-koštanu bol, proljev, mučninu, reakcije na infuziju, osip, smanjeni apetit i periferni edem. Najčešći ozbiljni rizici povezani s primjenom avelumaba su pneumonitis, hepatitis, kolitis, endokrinopatije i nefritis. Avelumab se ne smije primjenjivati u žena koje su trudne ili koje doje.
Izvor:
FDA, Lancet Oncology
