FDA odobrila prvu stanično-baziranu gensku terapiju za beta-talasemiju
Američka agencija za hranu i lijekove (FDA) odobrila je betibeglogene autotemcel, prvu stanično baziranu gensku terapiju za liječenje odraslih i pedijatrijskih pacijenata s beta-talasemijom kojima je potrebna redovita transfuzije crvenih krvnih stanica. Odobrenje se temeljilo na dvije multicentrične kliničke studije.
Betibeglogene autotemcel je jednokratni proizvod za gensku terapiju s jednom dozom. Svaka doza prilagođena je i stvorena pomoću pacijentovih vlastitih matičnih stanica koštane srži, koje su genetski modificirane za proizvodnju funkcionalnog beta-globina.
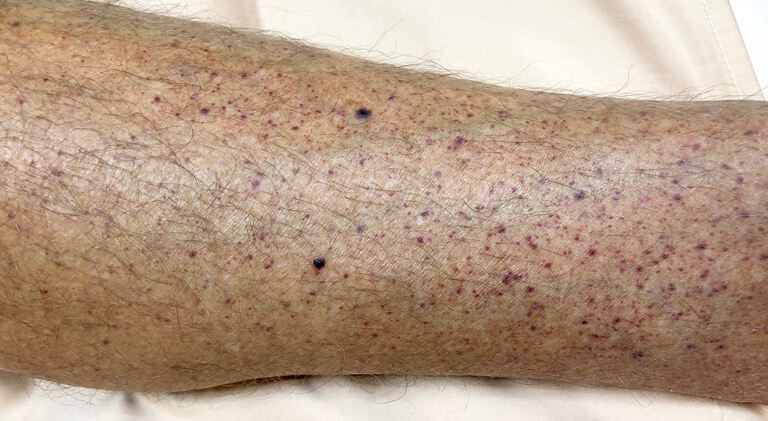
Najčešće nuspojave uključivale su smanjene razine trombocita i drugih krvnih stanica, mukozitis, febrilnu neutropeniju, povraćanje, vrućicu, alopeciju, krvarenje iz nosa, bol u trbuhu, mišićno-koštanu bol, kašalj, glavobolju, proljev, osip, zatvor, mučninu, smanjen apetit, poremećaj pigmentacije i svrbež.
Obzirom na potencijalni rizik od raka krvi koji je povezan s ovim liječenjem, pacijentima koji primaju betibeglogene autotemcel krv treba kontrolirati najmanje 15 godina radi otkrivanja raka. Jednako tako, pacijente također treba pratiti zbog reakcija preosjetljivosti tijekom primjene te zbog trombocitopenije i krvarenja.
Izvor:
FDA